Pourquoi ?
Les cellules souches, classiquement définies par leur capacité d’autorenouvellement et de différenciation, sont présentes dans tous les tissus adultes. Elles sont cependant rares et difficilement accessibles, à l’exception des cellules souches hématopoïétiques et cellules souches mésenchymateuses. Les seules cellules souches capables de donner naissance à l’ensemble des tissus de l’organisme sont les cellules souches embryonnaires, initialement dérivées chez la souris en 1981 puis chez l’homme en 1998.
Le domaine des cellules souches a connu une véritable révolution au cours de la dernière décennie grâce aux travaux de Shinya Yamanaka sur la reprogrammation des cellules adultes en cellules souches pluripotentes induites (2006). La faisabilité de ce concept avait été étudiée par John Gurdon dès les années 1960. Les deux pionniers ont ainsi partagé le Prix Nobel de Physiologie et Médecine en 2012.
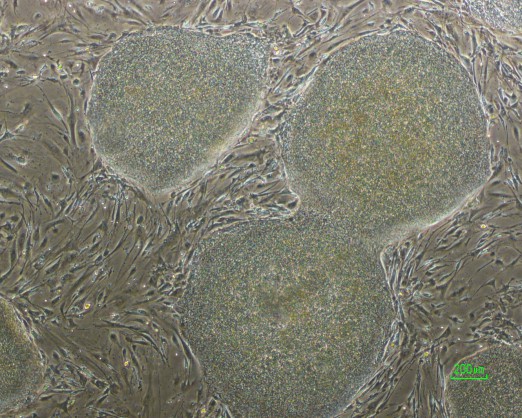
La méthode de production de cellules souches pluripotentes induites (iPS) s’affranchit de l’utilisation de l’embryon. La reprogrammation des cellules adultes vers la pluripotence est induite par la surexpression de 4 gènes agissant en synergie : Oct4, Sox2, Klf4 et c-Myc. D’autres gènes, comme Lin28 et Nanog, sont également capables d’induire la pluripotence. Toutes les cellules adultes sont reprogrammables avec une efficacité variable. Cette reprogrammation implique l’acquisition de deux propriétés fondamentales des cellules souches embryonnaires : l’autorenouvellement (division cellulaire symétrique théoriquement illimitée) et la pluripotence (capacité de se différencier dans tous les lignages de l’organisme en présence de stimuli adaptés).
Les cellules iPS ouvrent des perspectives majeures avec des enjeux scientifiques, médicaux, économiques et sociétaux dans les domaines de:
La médecine personnalisée axée sur les maladies génétiques mono- ou polygéniques.
- Les maladies rares avec l’étude physiopathologique et la découverte de nouvelles pistes thérapeutiques.
- Les cancers avec la découverte et le développement de nouveaux médicaments ciblant les cellules souches tumorales.
- Etude pharmaco-génomique : efficacité et toxicité des médicaments, toxicité prédictive dans le contexte des cellules souches en fonction du génome, épigénome et polymorphisme des patients.
La médecine régénérative axée sur l’étude du potentiel de réparation et régénération des organes via la greffe de tissus (thérapies cellulaires et géniques) ou d’organes construits par bioingénierie.
INGESTEM constitue un pôle d’excellence rassemblant les expertises scientifique et technologique pour relever l’ensemble de ces défis.